国家生物信息中心合作开发延缓心脏衰老的基因疗法
心脏是人体循环系统的核心动力器官,其结构和功能的完整性对于生命和健康的维系至关重要。根据世界卫生组织和全球健康研究数据,心血管疾病长期以来一直是人类健康的“头号杀手”。随着年龄增长,心脏逐渐出现结构重塑、收缩与舒张功能减退以及心肌纤维化等衰老特征,显著增加了冠心病、心力衰竭、心律失常等心脏疾病的风险,并且常常与高血压、动脉粥样硬化等疾病交织存在,进一步加重疾病负担。然而,当前针对心脏衰老的干预手段非常有限。深入解析心脏衰老的分子机制,对于开发延缓心脏功能退化、预防老年相关心血管疾病的新策略具有极为重要的科研意义和临床应用价值。
4月29日,国家生物信息中心张维绮团队联合中国科学院动物研究所曲静、刘光慧团队,首都医科大学附属北京安贞医院姚艳团队,于Nature Cardiovascular Research 杂志在线发表了题为“ARID5A Orchestrates Cardiac Aging and Inflammation through MAVS mRNA Stabilization”的研究论文。该研究利用人类心脏衰老模型,系统解析了人类心脏衰老过程中的表型和分子变化,首次揭示RNA结合蛋白ARID5A通过稳定MAVS mRNA激活炎症反应,从而驱动心脏衰老的新机制。此外,研究团队开发了靶向抑制ARID5A的基因疗法,在小鼠体内成功逆转心脏衰老相关表型,实现衰老心脏的“年轻化”。这一成果为揭示人类心脏衰老的分子机制提供了重要线索,提示ARID5A-MAVS信号轴有望成为延缓心脏衰老及防治年龄相关心血管疾病的全新靶点。
研究团队历时6年,系统地解析了人类心脏样本的多维度衰老特征。他们发现,衰老心脏不仅表现出多种衰老标志物的累积和表观遗传不稳定性的增加,还在组织层面出现纤维化、心肌细胞肥大以及心脏血管网密度降低等现象。通过构建高分辨率的心脏衰老单细胞图谱,研究团队锁定了内皮细胞、成纤维细胞和心肌细胞为衰老敏感细胞类型。这三个细胞群体在衰老过程中呈现出显著的基因表达波动,其中炎症相关通路的激活最为突出,并伴随着B细胞、巨噬细胞等免疫细胞的浸润增加,形成了“慢性炎症微环境”。
通过构建高维加权基因共表达网络,识别到RNA结合蛋白ARID5A在上述细胞类型中的表达上调是与心脏衰老密切相关的事件。分析发现,随着年龄增长,ARID5A的表达在泛细胞类型(心肌细胞、心脏成纤维细胞和内皮细胞)中显著升高。过表达ARID5A加速人心肌细胞、心脏成纤维细胞和冠状动脉内皮细胞衰老,反之,敲低ARID5A的表达则延缓这三类细胞衰老。研究人员进一步利用PAR-CLIP-seq技术在全转录组水平搜索ARID5A的结合位点,鉴定出线粒体抗病毒信号蛋白(MAVS)为ARID5A的下游靶基因。ARID5A的过表达延长MAVS mRNA的半衰期,增加MAVS的转录和蛋白水平,继而激活NF-κB和TBK1信号通路,触发IL-6等炎性因子级联释放,最终加速细胞衰老。因此,ARID5A如同心脏衰老的‘加速器’,通过表观转录调控放大炎症信号,形成恶性循环,最终导致心脏功能衰退。
那么抑制这一‘加速器’可以延缓逆转心脏衰老表型吗?为了回答这一科学问题,研究团队在老年小鼠心肌中注射靶向ARID5A的短发夹RNA慢病毒载体,6周后,他们发现不仅心脏细胞衰老标志物显著降低,炎症标志物明显减少,而且心肌纤维化面积下降了66%,收缩功能指标(射血分数)提升了33%。此外,老年小鼠的抓力和运动能力也显著增强。这是团队首次在活体哺乳动物中证实,通过抑制单一基因可以系统性地逆转心脏衰老表型,提示ARID5A-MAVS通路可能成为延缓心脏衰老的“黄金靶点”。因此,本研究为开发基因治疗(通过不同途径递送ARID5A沉默元件)以及针对ARID5A-MAVS轴的小分子抑制剂预防年龄相关心脏疾病提供了重要依据。
综上所述,该研究揭示了ARID5A-MAVS是调控人心脏衰老过程中的关键分子开关,揭示了表观转录调控促进衰老-炎症恶性循环的新机制,为发展干预心脏衰老的基因疗法提供了潜在策略。
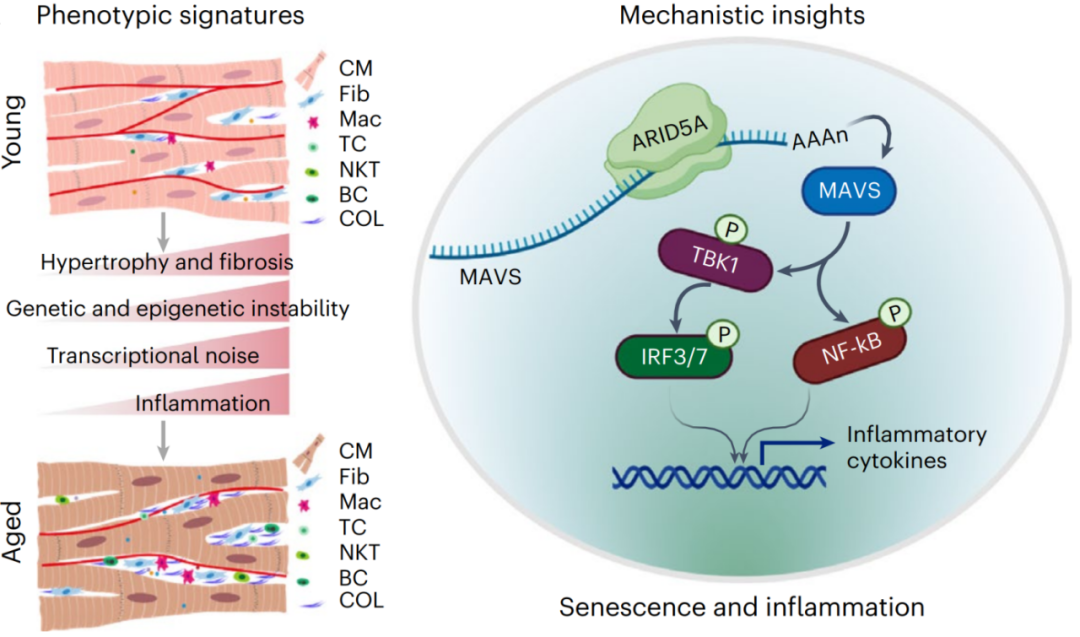
ARID5A驱动人类心脏衰老的分子机制
该研究由国家生物信息中心、中国科学院动物研究所、首都医科大学附属北京安贞医院等多家机构合作完成。国家生物信息中心张维绮研究员、中国科学院动物研究所曲静研究员、刘光慧研究员、首都医科大学附属北京安贞医院姚艳研究员为论文共同通讯作者。国家生物信息中心助理研究员范艳玲、中国科学院动物研究所博士研究生郑彦东、北京干细胞与再生医学研究所副研究员张译元、四川大学华西医院研究员徐岗和威斯康辛州密尔沃基市威斯康辛医学院心血管中心研究员刘纯为论文共同第一作者。






