北京基因组所(国家生物信息中心)揭示共转录m6A修饰建立机制及其功能
4月2日,中国科学院北京基因组研究所(国家生物信息中心)任捷团队和杨运桂团队合作在Molecular Cell在线发表了题为“DDX21 mediates co-transcriptional RNA m6A modification to promote transcription termination and genome stability”的研究论文,揭示了三链核酸结构R-loop、解旋酶DDX21与m6A甲基转移酶METTL3之间的协同机制,以及促进转录终止、维持基因组稳定性的功能。
在基因转录过程中,新生成的RNA可以和模板DNA互补,在染色质上形成由DNA:RNA杂合链和单链DNA组成的三链结构,这种核酸结构被称为R-loop,它的稳态失衡是多种疾病的病理基础。而N6-甲基腺嘌呤(m6A)是对mRNA生命周期进行调控的重要修饰,参与到细胞分化与个体发育、应对环境压力、免疫系统功能、肿瘤发生与发展以及病毒感染等多种生命过程。大约半数m6A在新生RNA上随转录生成,但对如何决定共转录修饰的发生、这些修饰有何功能知之甚少。
研究团队通过分析m6A甲基转移酶复合物的三种关键组分(METTL3/METTL14/WTAP)免疫共沉淀的蛋白质组份,鉴定出DEAD-box解旋酶DDX21作为m6A甲基转移酶复合物的一个新型互作因子。随后,团队开发并应用了针对新生RNA的光激活核糖核苷增强交联免疫沉淀高通量测序(caPAR-CLIP-seq),结合基于单链DNA建库的DNA:RNA杂合链免疫共沉淀高通量测序(ssDRIP-seq)分析,发现R-loop、DDX21和METTL3在基因组上具有显著的共定位。当R-loop或DDX21缺失时,METTL3在染色质上的定位显著降低,导致染色质相关RNA(caRNA)上m6A水平下降,尤其是在转录终止位置。研究进一步显示,DDX21对m6A修饰的促进作用依赖于其解旋酶活性。
通过绘制RNA聚合酶转录位点的高分辨率图谱,研究团队揭示了DDX21与METTL3协同作用,通过调控m6A共转录形成,并借助其“阅读器”蛋白YTHDC1,共同在促进XRN2介导的转录终止过程中发挥着重要作用,这一过程对于维持基因组的稳定性也至关重要。阻断复制过程或者采用CRISPR靶向策略精确抑制转录,可以有效缓解这种在转录通读区域的基因组不稳定性。
研究团队在前期研究中发现了m6A调控R-loop稳态的机制,而本研究提出了一种R-loop-DDX21-METTL3介导的m6A共转录修饰的新机制,阐明了新生RNA如何通过m6A修饰保证基因组功能和结构稳定性,为共转录甲基化的建立及其调控作用补上了缺失的一环。通过协调一系列的分子招募和酶活性,该研究架起了联接表观转录组建立、转录终止协调以及基因组稳定性维持之间的知识桥梁。深入探索R-loop-DDX21-METTL3-m6A调控轴的核心结构域和关键酶活性,将有助于发掘能够调节m6A表观转录组的新靶点。
中国科学院北京基因组研究所(国家生物信息中心)任捷研究员、杨运桂研究员和刘倩兰助理研究员为论文共同通讯作者。北京基因组研究所(国家生物信息中心)博士生郝金栋、助理研究员刘倩兰、博士生刘梦霞为本文的共同第一作者。中国科学院上海生物化学与细胞生物学研究所陈玲玲研究员,中国科学院北京基因组研究所(国家生物信息中心)张维绮研究员,中国科学院生物物理研究所杨福全研究员,清华大学孙前文教授,复旦大学麻锦彪教授对本项研究提供了重要的材料和讨论支持。研究工作得到了国家重点研发计划、中国科学院战略重点研究计划、国家自然科学基金等项目支持。
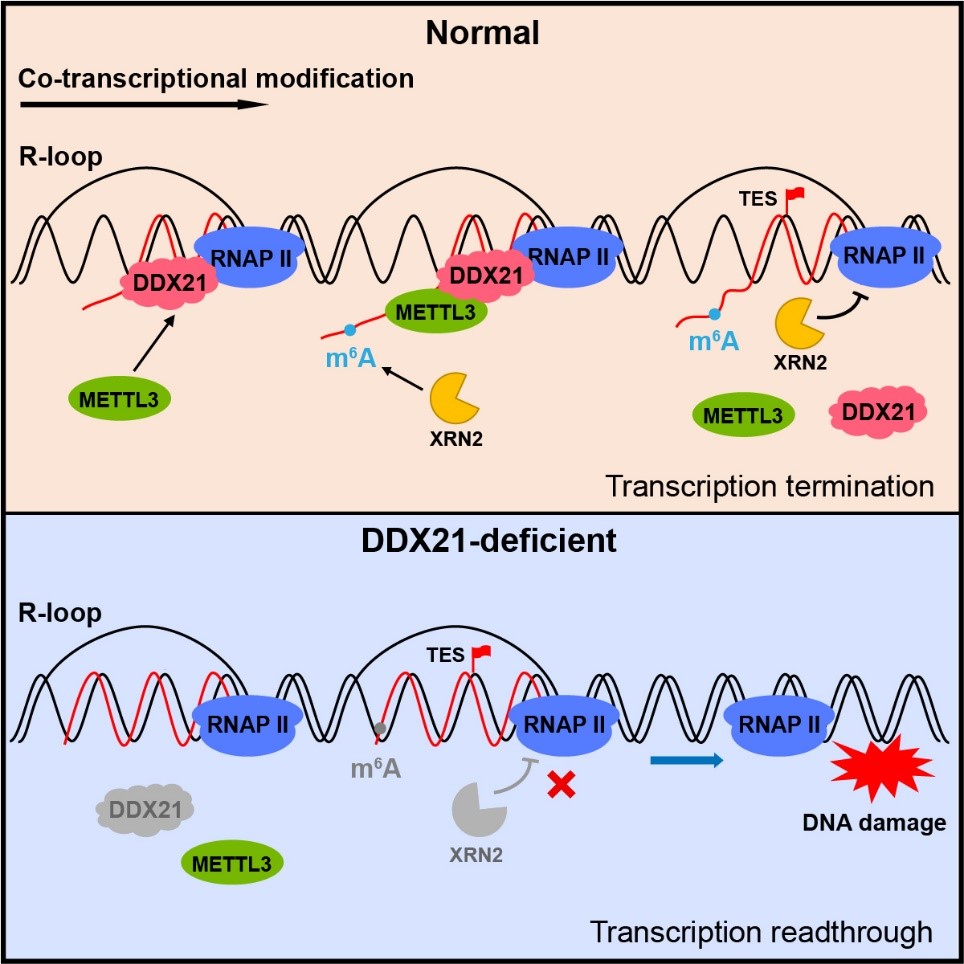
DDX21促进m6A共转录修饰及转录终止机制示意图






