北京基因组所(国家生物信息中心)合作揭示RNA m6A甲基化促进SHH亚型髓母细胞瘤进展的重要作用机制
髓母细胞瘤是儿童最常见的恶性脑肿瘤之一,具有WNT、SHH、G3和G4四个分子分型。其中SHH-MB的发生源于hedgehog信号通路持续激活引起小脑颗粒神经元前体细胞过度增殖,由于其内部异质性强、病人预后相差很大等临床问题,目前尚缺乏有效的靶向治疗方法。N6-甲基腺苷(N6- methyladenosine, m6A)是哺乳动物mRNA最常见的表观转录标记,能够调节RNA出核、降解和翻译等多个RNA代谢过程,并通过靶向特定信号通路调控神经发育等多个生物学功能。团队前期研究发现RNA m6A甲基化可调控小鼠小脑颗粒神经元的增殖与分化(Genome Biology, 2018),但RNA m6A甲基化是否参与SHH-MB肿瘤的进展过程还不甚清楚,因此系统开展表观转录组研究对SHH-MB肿瘤诊断及治疗具有重要意义。
近日,中国科学院北京基因组研究所(国家生物信息中心)宋述慧团队与医学科学院基础医学研究所佟伟民教授团队、北京天坛医院刘丕楠教授团队联合揭示RNA m6A甲基转移酶METTL3通过调控Sonic hedgehog通路中PTCH1和GLI2 m6A甲基化促进SHH亚型髓母细胞瘤(Sonic hedgehog signaling-medulloblastoma, SHH-MB)进展,并以“METTL3 regulates m6A methylation of PTCH1 and GLI2 in Sonic hedgehog signaling to promote tumor progression in SHH-medulloblastoma” 为题在Cell Reports 正式发表。该研究首次报道了SHH-MB 中,m6A甲基转移酶METTL3表达升高导致了肿瘤中PTCH1和GLI2 RNA m6A甲基化水平升高,使得hedgehog信号通路过度激活,进而促进了肿瘤的进展。
团队发现m6A 甲基转移酶METTL3在SHH-MB中过表达,与预后呈负相关。通过肿瘤组织的m6A-seq发现SHH-MB肿瘤中多个转录本的甲基化修饰出现异常,且高甲基化的转录本与hedgehog信号通路高度相关。体外实验证明METTL3通过催化m6A调控髓母细胞瘤细胞的增殖和迁移、促进细胞凋亡。通过敲低METTL3前、后的髓母细胞瘤细胞系进行的m6A-seq及分子水平的研究,发现METTL3的主要作用底物是hedgehog信号通路中的两个核心因子PTCH1和GLI2,并且通过调控RNA降解和翻译的方式、干扰抑癌基因PTCH1和原癌基因GLI2的表达,进而造成hedgehog信号通路的持续激活。随后,通过原位裸鼠成瘤实验证实,METTL3缺失能够减缓SHH-MB进展,延长小鼠生存期。同时,利用病人来源的SHH-MB肿瘤原代细胞开展的药物实验证明METTL3特异性抑制剂STM2457亦可以有效地杀伤SHH-MB肿瘤细胞。以上结果均提示METTL3有望成为SHH-MB治疗的潜在靶点。
该研究首次阐明SHH-MB肿瘤进展的表观转录调控机制,同时证明METTL3具有成为SHH-MB全新治疗靶点的潜在可能,为开发相关治疗策略提供了重要思路。
该研究得到中科院青年创新促进会、中国医学科学院医学与健康科技创新工程等项目的资助。基础医学研究所牛亚梅研究员、佟伟民教授,北京天坛医院刘丕楠教授和中国科学院北京基因组研究所宋述慧研究员为论文共同通讯作者,基础医学研究所张至玮博士、北京基因组研究所滕徐菲博士、北京天坛医院赵赋副研究员和基础医学研究所马春卉助理研究员为论文的共同第一作者。
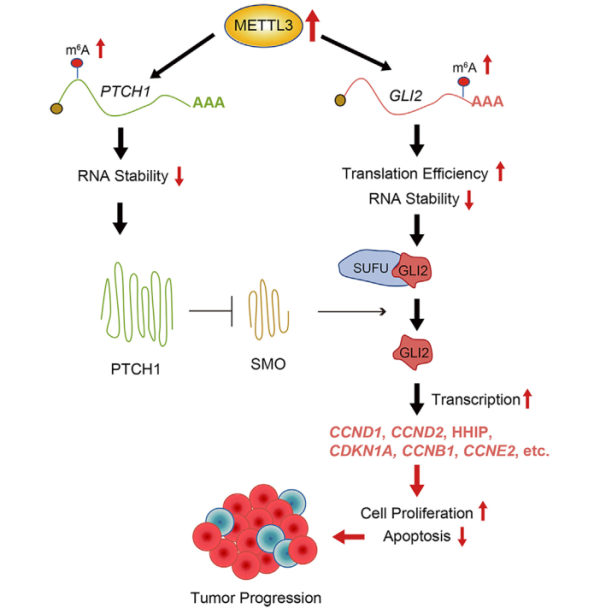
METTL3通过调控PTCH1和GLI2 RNA m6A甲基化促进SHH-MB的发展进程






